
Prorrogadas para 2 de agosto as inscrições para o Inova SVS
27 de julho de 2020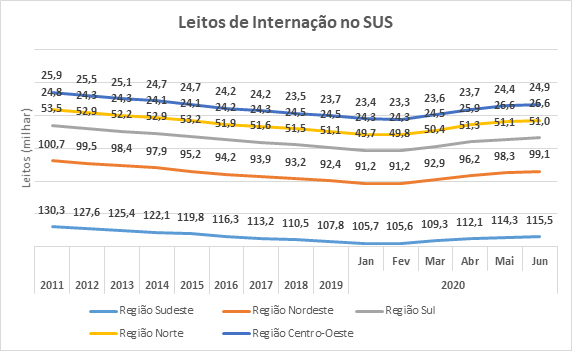
Covid-19 interrompe década de queda em leitos de internação no Sistema Único de Saúde (SUS)
27 de julho de 2020fonte: Anvisa
A Diretoria Colegiada da Anvisa (Dicol) aprovou, nesta terça-feira (21/7), a realização de consultas públicas para proposta de resolução sobre o monitoramento econômico de dispositivos médicos e duas instruções normativas relacionadas ao tema. A ideia é realizar uma revisão da Resolução da Diretoria Colegiada (RDC) 185/2006 a fim de contribuir para a redução da disfuncionalidade do mercado de dispositivos médicos no Brasil.
As consultas públicas foram aprovadas por unanimidade na 12ª Reunião Ordinária Pública da Dicol de 2020 e, quando abertas, terão prazo de 60 dias para manifestação da sociedade. Os diretores enfatizaram, durante o processo de votação, a importância da iniciativa para a regulação de dispositivos médicos e seus consequentes impactos positivos para o setor regulado e a população.
Entenda
Durante a realização da Análise de Impacto Regulatório (AIR) foi constatado o problema da ampla disfuncionalidade do mercado de dispositivos médicos no país, provocada, entre outras razões, pela existência de informações imperfeitas e assimétricas, sendo esse o aspecto do problema que foi selecionado para atuação da Anvisa. Essa disfuncionalidade leva a uma dispersão nos preços praticados. Para se ter uma ideia, a diferença nos preços de alguns dispositivos médicos variou 2,5 vezes entre as regiões brasileiras.
A nova proposta de RDC deverá definir o monitoramento econômico de dispositivos médicos. As instruções normativas (INs), por sua vez, vão estabelecer, respectivamente, o escopo de dispositivos médicos selecionados para monitoramento econômico e o conjunto de atributos técnicos desses dispositivos.
Espera-se, com a nova proposta de regulação, contribuir para a redução relativa de preços dos dispositivos médicos, bem como para a redução da dispersão de preços, além de reduzir a assimetria da informação, imprimir mais transparência, possibilitar a comparação de produtos similares e facilitar a definição de preços de referência.
É importante observar que a AIR contou com vários instrumentos de participação social, inclusive com a submissão de relatório preliminar de AIR à Tomada Pública de Subsídios, em que foram recebidos 26 formulários de participação, com cerca de 150 contribuições sobre os diversos pontos do relatório. Todos os participantes sinalizaram que a situação relatada no relatório é, de fato, um problema e a maioria concordou com a opção regulatória selecionada.
Na AIR foram comparadas três opções regulatórias normativas, por meio de análise qualitativa, análise de custo-minimização e análise de custo-benefício. Nessa comparação, a opção normativa considerada mais adequada foi a que se refere ao monitoramento econômico e à divulgação de informações sobre dispositivos médicos, especialmente porque já existe competência legal da Agência e permite atender ao Acórdão 435/2016 do Tribunal de Contas da União (TCU). Ademais, a opção demonstrou ter melhor relação custo-benefício e sua viabilidade técnica e operacional foi observada em experiência-piloto já realizada.






